
BaCl2 + NaHSO4 → BaSO4 + Na2SO4 + HCl | BaCl2 ra BaSO4
Phản ứng BaCl2 + NaHSO4 → BaSO4 + Na2SO4 + HCl
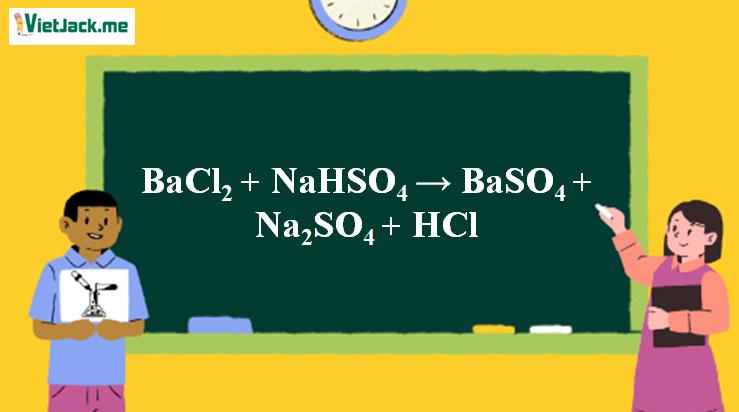
1. Phương trình phản ứng BaCl2 + NaHSO4 → BaSO4 + Na2SO4 + HCl
BaCl2 + NaHSO4→ BaSO4 + NaCl + HCl
2. Điều kiện phản ứng xảy ra
Nhiệt độ thường
Cho BaCl2 tác dụng với NaHSO4.
Hiện tượng: Có kết tủa trắng.
3. Viết phương trình ion rút gọn của phản ứng BaCl2 + NaHSO4
Phương trình phân tử:
NaHSO4 + BaCl2 → BaSO4 + HCl + NaCl
Phương trình ion rút gọn:
HSO4− + Ba2+→ BaSO4 + H+
4. Bản chất của các chất tham gia phản ứng
4.1. Bản chất của BaCl2 (Bari clorua)
BaCl2mang đầy đủ tính chất hoá học của muối tác dụng được với muối khác.
4.2. Bản chất của NaHSO4 (Natri hidrosunfat)
NaHSO4 tác dụng được với muối với điều kiện phản ứng xảy ra sản phẩm phải có chất ít tan, bay hơn và axit mới yếu hơn axit ban đầu.
5. Tính chất hoá học của BaCl2
5.1. Tính chất vật lí & nhận biết
Tính chất vật lý:
- Là chất rắn, có màu trắng và tan tốt trong nước.
- Có độc tính.
- Đốt cho ngọn lửa màu xanh lá cây sáng.
Nhận biết: Cho vài giọt H2SO4 vào dung dịch, thấy xuất hiện kết tủa trắng, không tan trong axit.
BaCl2 + H2SO4 → BaSO4 + 2HCl
5.2. Tính chất hóa học
Mang tính chất hóa học của muối
Tác dụng với muối
BaCl2 + 2AgNO3 → 2AgCl + Ba(NO3)2
BaCl2 + CuSO4 → BaSO4 + CuCl2
Tác dụng với axit:
BaCl2 + H2SO4 → BaSO4 + 2HCl
6. Ứng dụng của BaCl2
- Do là một muối bari giá rẻ và tan trong nước, bari clorua có ứng dụng rộng rãi trong phòng thí nghiệm. Nó thường được sử dụng để kiểm tra sự có mặt của ion sunfat
- Trong ngành công nghiệp, bari clorua chủ yếu được sử dụng trong việc tinh chế dung dịch nước muối trong các nhà máy clorua caustic và cũng trong sản xuất muối xử lý nhiệt, thép, trong sản xuất bột màu, và trong sản xuất các muối bari khác.
- BaCl2 cũng được dùng trong pháo hoa để tạo màu xanh lá cây sáng. Tuy nhiên tính độc của nó đã làm hạn chế khả năng ứng dụng.
7. Tính chất của NaHSO4
7.1. Tính chất vật lí
Natri Hidro Sunfat là sản phẩm dạng hạt, khô rất dễ vận chuyển cũng như bảo quản. NaHSO4 là chất hút ẩm mạnh ở dạng khan. Dung dịch của muối này có tính axit mạnh. Nhiệt độ sôi và nhiệt độ nóng chảy cùng ở 315 độ C. Khối lượng mol của NaHSO4 nằm trong khoảng 120.06 g/mol, khối lượng riêng 2.742 g/cm3. Đây là một hóa chất không tan trong amoniac nhưng lại phân hủy trong cồn.
7.2. Tính chất hóa học
- NaHSO4 làm đổi màu quỳ tím sang đỏ
- NaHSO4 tác dụng với bazơ như NaOH, KOH, Ca(OH)2, Ba(OH)2
NaHSO4 + NaOH → Na2SO4 + H2O
NaHSO4 + Ba(OH)2 → BaSO4 + Na2SO4 + H2O
- Tác dụng với kim loại
NaHSO4 + Zn → ZnSO4 + Na2SO4 + H2
NaHSO4 + Na → Na2SO4 + H2
8. Câu hỏi vận dụng
Câu 1. Chất nào sau đây không tạo kết tủa khi cho vào dung dịch AgNO3
A. KBr
B. K3PO4
C. HCl
D. H3PO4
Lời giải:
Đáp án: D
Câu 2. Trong các cặp chất sau đây, cặp chất nào cùng tồn tại trong dung dịch?
A. AlCl3 và Na2CO3
B. HNO3 và NaHCO3
C. NaAlO2 và KOH
D. NaCl và AgNO3
Lời giải:
Đáp án: C
Câu 3. Cho dung dịch Fe2(SO4)3 phản ứng với dung dịch Na2CO3 thì sản phẩm tạo ra là:
A. Fe2(CO3)3 và Na2SO4
B. Na2SO4; CO2 và Fe(OH)3
C. Fe2O3; CO2; Na2SO4 và CO2
D. Fe(OH)3; CO2; Na2SO4; CO2
Lời giải:
Đáp án: B
Câu 4. Các ion có thể tồn tại trong cùng một dung dịch là:
A. Na+, NH4+, SO42-, Cl-.
B. Mg2+, Al3+, NO3-, CO32-.
C. Ag+, Mg2+, NO3-, Br-.
D. Fe2+, Ag+, NO3-, CH3COO-.
Lời giải:
Đáp án: A
Xem thêm các phương trình phản ứng hóa học khác:
Ca(OH)2 + HCl → CaCl2 + H2O
Ca(OH)2 + H2SO4 ⟶ CaSO4 + H2O
CaCO3 → CaO + CO2
CaCO3 + HCl → CaCl2 + CO2 + H2O
CaCO3 + HNO3 → Ca(NO3)2 + CO2 + H2O
Link nội dung: https://appstore.edu.vn/nahso4bacl2-a32915.html