
Lý thuyết Thành phần của nguyên tử – Hóa 10 Chân trời sáng tạo
Lý thuyết Hóa học 10 Bài 2: Thành phần của nguyên tử
Bài giảng Hóa học 10 Bài 2: Thành phần của nguyên tử
A. Lý thuyết Thành phần của nguyên tử
I. Thành phần cấu tạo nguyên tử
Nguyên tử gồm hạt nhân chứa proton, neutron và vỏ nguyên tử chứa electron.
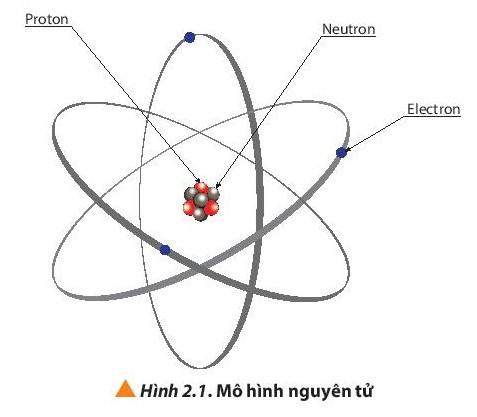
II. Sự tìm ra electron
- Năm 1897, nhà vật lí người Anh J.J Thomson thực hiện thí nghiệm phóng điện qua một ống thủy tinh gần như chân không (gọi là ống tia âm cực). Ông quan sát thấy màn huỳnh quang trong ống phát sáng do những tia phát ra từ cực âm (gọi là tia âm cực) và những tia này bị hút về cực dương của trường điện, chứng tỏ chúng tích điện âm. Đó chính là chùm các hạt electron.
⇒ Trong nguyên tử tồn tại một loại hạt có khối lượng và mang điện tích âm, được gọi là electron.
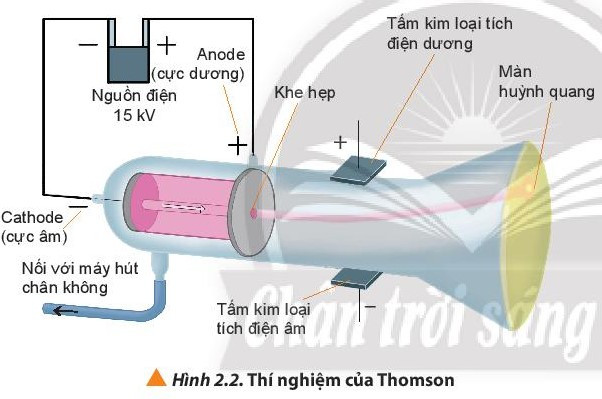
- Hạt electron, kí hiệu là e, có:
+ Điện tích: qe = - 1,602 × 10-19 C (coulomb).
+ Khối lượng: me = 9,11 × 10-28g.
- Người ta chưa phát hiện được điện tích nào nhỏ hơn 1,602 × 10-19 C nên nó được dùng làm điện tích đơn vị, điện tích của electron được quy ước là -1.
III. Sự khám phá ra hạt nhân nguyên tử
- Năm 1911, nhà vật lí người New Zealand là E. Rutherford đã tiến hành bắn phá một chùm hạt alpha lên một lá vàng siêu mỏng và quan sát đường đi của chúng sau khi bắn phá bằng màn huỳnh quang.
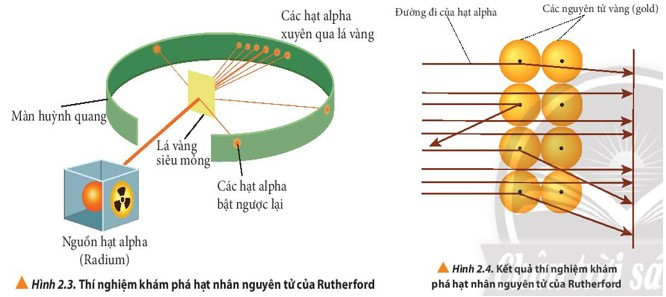
- Kết quả:
+ Hầu hết các hạt alpha đều xuyên thẳng qua lá vàng, một số ít bị lệch hướng và một số rất ít hạt bật trở lại.
- Giải thích kết quả:
+ Do nguyên tử có cấu tạo rỗng, ở tâm chứa một hạt nhân mang điện tích dương có kích thước rất nhỏ so với kích thước nguyên tử nên hầu hết các hạt alpha có thể đi xuyên qua lá vàng.
- Kết luận:
+ Nguyên tử có cấu tạo rỗng, gồm hạt nhân ở trung tâm và lớp vỏ là các electron chuyển động xung quanh hạt nhân.
+ Nguyên tử trung hòa về điện: số đơn vị điện tích dương của hạt nhân bằng số đơn vị điện tích âm của các electron trong nguyên tử.
IV. Cấu tạo hạt nhân nguyên tử
- Vào năm 1918, khi bắn phá hạt nhân nguyên tử nitrogen bằng các hạt α, Rutherford đã nhận thấy sự xuất hiện hạt nhân nguyên tử oxygen và một loại hạt mang một đơn vị điện tích dương (eo hay +1), đó là proton (kí hiệu là p).
- Năm 1932, khi dùng các hạt α để bắn phá hạt nhân nguyên tử beryllium, J. Chadwick nhận thấy sự xuất hiện của một loại hạt có khối lượng xấp xỉ hạt proton, nhưng không mang điện. Ông gọi chúng là neutron (kí hiệu là n).
- Kết luận: Hạt nhân nguyên tử gồm hai loại hạt là proton và neutron.
+ Proton kí hiệu là p, mang điện tích dương (+1)
+ Neutron kí hiệu là n, không mang điện.
+ Proton và neutron có khối lượng gần bằng nhau.
V. Kích thước và khối lượng nguyên tử
1. Kích thước nguyên tử
- Đường kính của nguyên tử lớn hơn đường kính của hạt nhân khoảng 10 000 lần.
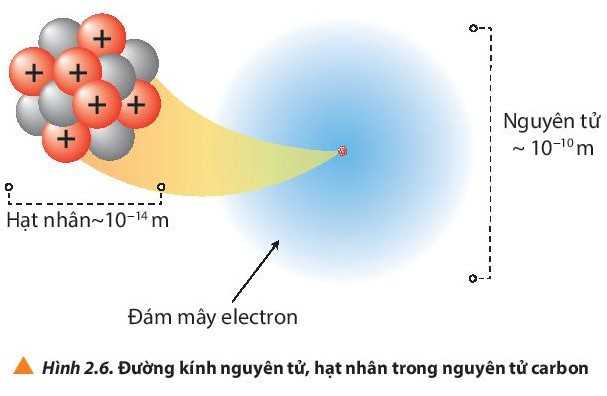
- Đơn vị nanomet (nm) hay angstrom (Ao) thường được sử dụng để biểu thị kích thước nguyên tử.
1nm=10−9m; 1Ao=10−10m; 1nm=10Ao
2. Khối lượng nguyên tử
- Để biểu thị khối lượng nguyên tử, các hạt proton, neutron và electron, người ta dùng đơn vị khối lượng nguyên tử, kí hiệu là amu.
1 amu bằng 112 khối lượng nguyên tử của carbon - 12
1 amu = 1,66 × 10-24g.
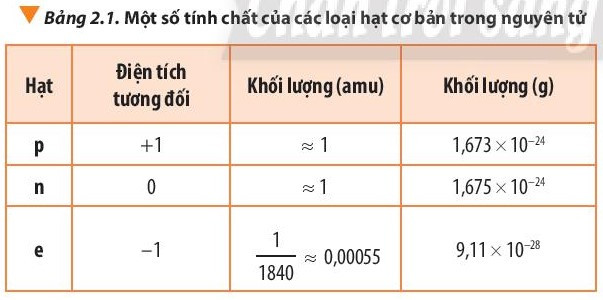
- Khối lượng của nguyên tử gần bằng khối lượng hạt nhân do khối lượng của các electron (me ≈ 0,00055 amu) không đáng kể so với khối lượng của proton (mp ≈ 1 amu) và neutron (mn ≈ 1 amu).
- Cách tính: Khối lượng nguyên tử = số p + số n
Ví dụ: Nguyên tử oxygen có 8 proton, 8 neutron và 8 electron.
⇒ Khối lượng nguyên tử oxygen = số p + số n = 8 + 8 = 16 amu.
B. Trắc nghiệm Thành phần của nguyên tử
Câu 1. Loại hạt có khối lượng và mang điện tích âm tồn tại trong nguyên tử là
A. proton
B. hạt nhân
C. electron
D. neutron
Câu 2. Điện tích của một electron là
A. -1,602.10-19 C
B. -1 C
C. 1,602.10-19 C
D. 1 C
Câu 3. Khẳng định đúng là:
A. Nguyên tử có cấu tạo đặc khít, gồm hạt nhân ở trung tâm và lớp vỏ là các electron chuyển động xung quanh hạt nhân.
B. Nguyên tử có cấu tạo rỗng, gồm hạt nhân ở trung tâm và lớp vỏ là các electron chuyển động xung quanh hạt nhân.
C. Nguyên tử có cấu tạo rỗng, gồm electron ở trung tâm và hạt nhân chuyển động xung quanh.
D. Nguyên tử có cấu tạo đặc khít, gồm electron ở trung tâm và hạt nhân chuyển động xung quanh.
Câu 4. Nguyên tử gồm
A. hạt nhân chứa proton, neutron và vỏ nguyên tử chứa electron
B. hạt nhân chứa proton, neutron
C. hạt nhân chứa proton, electron và vỏ nguyên tử chứa neutron
D. hạt nhân và vỏ nguyên tử chưa proton
Câu 5. Khẳng định đúng là:
A. Số đơn vị điện tích dương của hạt nhân lớn hơn số đơn vị điện tích âm của các electron trong nguyên tử.
B. Số đơn vị điện tích âm của hạt nhân bằng số đơn vị điện tích dương của các electron trong nguyên tử.
C. Số đơn vị điện tích dương của hạt nhân bằng số đơn vị điện tích âm của các electron trong nguyên tử.
D. Số đơn vị điện tích dương của hạt nhân nhỏ hơn số đơn vị điện tích âm của các electron trong nguyên tử.
Câu 6. Nguyên tử oxygen có 8 electron, hạt nhân nguyên tử này có điện tích là
A. - 8
B. + 8
C. - 16
D. + 1
Câu 7. Hạt được tìm thấy trong hạt nhân và không mang điện là
A. proton
B. hạt bụi
C. electron
D. neutron
Câu 8. Hạt nhân nguyên tử gồm các loại hạt là
A. electron (e) và proton (p)
B. proton (p) và neutron (n)
C. electron (e) và neutron (n)
D. electron (e), proton (p) và neutron (n)
Câu 9. Thông tin sai là
A. Proton mang điện tích dương (+1).
B. Neutron không mang điện.
C. Proton và neutron có khối lượng gần bằng nhau.
D. Proton và neutron có điện tích bằng nhau.
Câu 10. Nguyên tử clo (chlorine) có điện tích hạt nhân là +17. Số proton và số electron trong nguyên tử này là
A. 17 proton, 35 electron
B. 10 proton, 7 electron
C. 17 proton, 17 electron
D. 7 proton, 10 electron
Xem thêm tóm tắt lý thuyết Hóa học 10 sách Chân trời sáng tạo hay, chi tiết khác:
Lý thuyết Bài 3: Nguyên tố hóa học
Lý thuyết Bài 4: Cấu trúc lớp vỏ electron của nguyên tử
Lý thuyết Bài 5: Cấu tạo bảng tuần hoàn các nguyên tố hóa học
Lý thuyết Bài 6: Xu hướng biến đổi một số tính chất của nguyên tử các nguyên tố, thành phần và một số tính chất của hợp chất trong chu kì và nhóm
Lý thuyết Bài 7: Định luật tuần hoàn - ý nghĩa của bảng tuần hoàn các nguyên tố hóa học
Link nội dung: https://appstore.edu.vn/ly-thuyet-hoa-10-chan-troi-sang-tao-a33826.html