Cấu tạo phân tử của Metan được chúng tôi sưu tầm và tổng hợp lí thuyết trong chương trình giảng dạy môn Hóa học lớp 9. Hi vọng rằng đây sẽ là những tài liệu hữu ích trong công tác giảng dạy và học tập của quý thầy cô và các bạn học sinh.
Lưu ý: Nếu bạn muốn Tải bài viết này về máy tính hoặc điện thoại, vui lòng kéo xuống cuối bài viết.
Câu hỏi: Nêu cấu tạo phân tử của metan?
Trả lời:
- Công thức cấu tạo của Metan:
- Trong công thức cấu tạo của metan chỉ có liên kết đơn.
- Những hiđrocacbon mạch hở, phân tử chỉ có liên kết đơn giống như metan gọi là ankan, có công thức chung CnH2n+2, với n lớn hơn hoặc bằng 1.
1. Metan là gì?
- Khí metan (methane) hay còn có tên gọi khác là khí bùn ao, được kí hiệu là CH4 trong hóa học.
- Là một hidrocacbon nằm trong dãy đồng đẳng akan. Chúng là thành phần chính của khí dầu mỏ, có trong tự nhiên khá nhiều. Metan được tạo ra trong quá trình chế biến, chưng cất hay sản xuất khí dầu mỏ. Chính vì vậy nó cũng xuất hiện trong gia đình của bạn vì nó có trong các bình gas.
2. Tính chất vật lý của metan
+ Metan là chất khí không màu không mùi, không vị.
+ Đây là một khí rất độc và dễ bắt cháy, tạo ra lửa màu xanh.
+ CH4 hóa lỏng khi ở −162°C, hóa rắn ở −183°C
+ Điểm bốc cháy là 537°C
+ Khối lượng riêng của metan là 0.717 kg/m3
+ Metan không có khả năng hòa tan trong các dung môi phân cực vì không có sự liên kết giữa các hidro, chúng chỉ tan trong dung môi không phân cực.
+ CH4 không có tính dẫn điện.
3. Tính chất hóa học của Metan
Tác dụng với Oxi
- Hiện tượng:
+ Khi đốt metan thấy các giọt nước nhỏ bám trên thành ống nghiệm
+ Sau khi đốt, rót nước vôi trong vào ống nghiệm, dung dịch nước vôi trong bị vẩn đục.
+ Tỏa nhiều nhiệt
- Giải thích:
+ Mêtan cháy tạo thành khí cacbondioxit và hơi nước.
+ Phương trình phản ứng:
- Chú ý: Hỗn hợp gồm một thể tích metan và hai thể tích oxi là hỗn hợp nổ mạnh (Người ta dùng bút vẽ các vạch chia thể tích lên bình thu khí. Chia bình thành 3 phần thể tích. Vì Oxi và metan đều ít tan trong nước nên thu khí bằng cách úp ngược bình và đầy nước. Đầu tiên người ta thu một phần thể tích khí Metan. Sau đó thu lấy hai phần thể tích khí oxi. Mục đích của việc đốt khí ở đầu ống thu khí và thấy ngọn lửa vẫn cháy chứng tỏ khí thoát ra từ ống thu khí là khí oxi. Đốt hỗn hợp một phản thể tích metan và 2 phần thể tích oxi tạo hỗn hợp nổ)
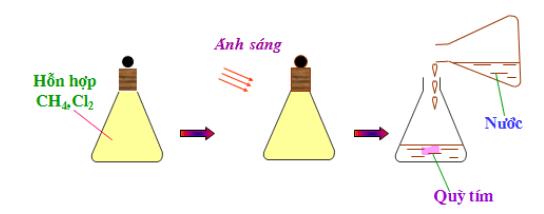
Tác dụng với Clo
- Metan đã tác dụng với clo khi có ánh sáng
- Phương trình hóa học:
- CH3Cl có tên gọi là metylclorua
- Trong phản ứng trên, ntử H của mêtan được thay thế 4 ntử clo, vì vậy phản ứng trên được gọi là phản ứng thế
4. Ứng dụng của Metan
+ Nhiên liệu
Mêtan là một nhiên liệu quan trọng. So với than đá, đốt cháy mêtan sinh ra ít CO2 trên mỗi đơn vị nhiệt giải phóng. Ở nhiều nơi, mêtan được dẫn tới từng nhà nhằm mục đích sưởi ấm và nấu ăn. Nó thường được biết tới với cái tên khí thiên nhiên.
+ Trong công nghiệp
Mêtan được dùng trong nhiều phản ứng hóa công nghiệp và có thể được chuyên chở dưới dạng khí hóa lỏng. Trong hóa công nghiệp, mêtan là nguyên liệu sản xuất hydro, methanol, axit axetic và anhydrit axetic.
+ Mêtan trong khí quyển Trái Đất
Mêtan trong khí quyển là một khí gây hiệu ứng nhà kính. Mật độ của nó đã tăng khoảng 150% từ năm 1750 và đến năm 1998, mật độ trung bình của nó trên bề mặt Trái Đất là 1745 ppb. Mật độ ở bán cầu Bắc cao hơn vì ở đó có nhiều nguồn mêtan hơn (cả thiên nhiên lẫn nhân tạo). Mật độ của mêtan thay đổi theo mùa, thấp nhất vào cuối mùa hè.
5. Metan có ở đâu trong tự nhiên?
+ Tạo ra từ các khí thải của việc đốt cháy nhiên liệu hóa thạch, hay cháy rừng.
+ CH4 còn có trong quá trình sinh học như ở trong ruột của động vật, tiêu biểu là sự men hóa trong đường ruột, dạ dày của động vật nhai lại.
+ Tạo ra do sự phân hủy kị khí ở những nơi ao hồ, đầm lầy, trầm tích dưới đáy biển… Dưới hầm cầu chúng cũng xuất hiện vì sự lên men yếm khí.
+ CH4 là một trong những thành phần chính của khí tự nhiên, đặc biệt là khí dầu mỏ, do đó mà chúng rất dễ bắt cháy.
+ CH4 còn có nhiều ở trong những hang động, đá giếng sâu. Vì thế, không nên tuyệt đối tự ý đi xuống dưới giếng, hố sâu khi không được chuẩn bị kĩ càng.
6. Khí Metan có độc hay không?
- Methane là khí không độc, tuy nhiên đây là chất khí rất dễ bắt lửa và có thể tạo thành hỗn hợp dễ nổ với không khí. Methane lại phản ứng mạnh với chất có tính oxy hóa, halogen, và một số hợp chất hóa học chứa halogen.
- Methane cũng gây ngạt nguy hiểm cho con người khi thao tác sử dụng nó trong một không gian kín. Nó sẽ gây ngứa khó chịu nếu nồng độ oxy trong không khí xung quanh giảm xuống dưới 16%.
7. Bài tập vận dụng
Câu 1. Chất nào sau đây có phản ứng thế với clo?
A. CO2 .
B. K.
C. O2.
D. CH4.
Lời giải:
Đáp án D
Các nguyên tử H trong metan có thể lần lượt bị thay thế bởi clo.
Câu 2. Đốt cháy hoàn toàn khí metan bằng khí oxi. Nếu hỗn hợp nổ mạnh thì tỉ lệ thể tích của khí metan và khí oxi là
A. 1 thể tích khí metan và 4 thể tích khí oxi.
B. 2 thể tích khí metan và 1 thể tích khí oxi.
C. 1 thể tích khí metan và 2 thể tích khí oxi.
D. 1 thể tích khí metan và 1 thể tích oxi.
Lời giải:
Đáp án C
Hỗn hợp gồm 1 thể tích metan và 2 thể tích oxi là hỗn hợp nổ mạnh.
Câu 3. Cho các chất sau: H2O, HBr, Cl2, O2, CO2, H2. Khí metan phản ứng được với
A. H2O, HBr.
B. Cl2, O2.
C. H2, Cl2.
D. O2, CO2.
Lời giải:
Đáp án B
Câu 4. Khí metan có lẫn tạp chất là khí cacbonic và khí sunfurơ. Để thu được khí metan tinh khiết cần
A. Dẫn hỗn hợp qua nước vôi trong dư.
B. Đốt cháy hỗn hợp rồi dẫn qua nước vôi trong.
C. Dẫn hỗn hợp qua bình đựng dung dịch H2SO4.
D. Dẫn hỗn hợp qua bình đựng dung dịch brom dư.
Lời giải:
Đáp án A
Dẫn hỗn hợp khí qua nước vôi trong dư. Khí CO2; SO2 phản ứng bị giữ lại, khí metan không phản ứng thoát ra khỏi dung dịch thu được metan tinh khiết.
CO2 + Ca(OH)2 → CaCO3↓ + H2O
SO2 + Ca(OH)2 → CaSO3 ↓ + H2O
-
Ngoài Cấu tạo phân tử của Metan đã được VnDoc giới thiệu, mời các bạn cùng tham khảo thêm Chuyên đề Hóa học lớp 9, Trắc nghiệm Hóa học 9, Lý thuyết môn Hóa học lớp 9 để hoàn thành tốt chương trình học THCS.